-
화학식량과 몰 파트 문제에서 자주 등장하는 자료 중 하나가 ‘밀도’이다. 이 밀도 자료는 화학식량과 몰 뿐만 아니라 다른 단원과 연계해서도 자주 등장한다. 이런 자료가 나오면 학생들은 벽을 느끼고 문제 풀이가 막히는 경우가 많다. 이런 자료가 나올 때 어떻게 풀어야 하는지 7월 학력평가 문제와 연결 지어 설명해 보려고 한다.
-
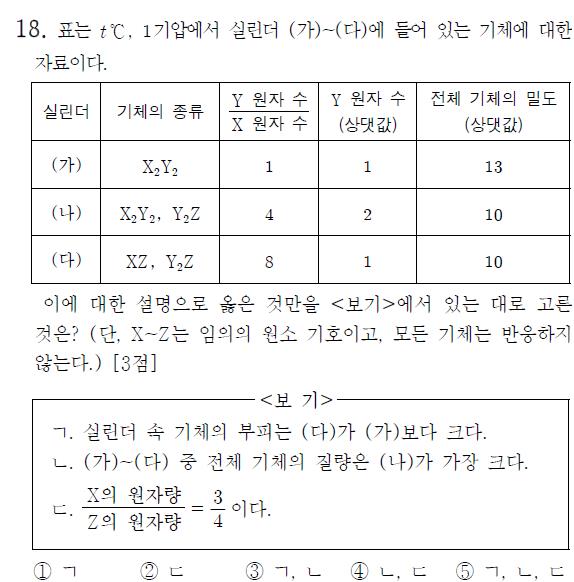
문제에서 같은 온도, 압력(t°C, 1기압) 기체에 대한 조건이 보이면 떠올려야 하는 포인트는 2가지이다. 1) V∝n 부피와 몰수가 비례한다. 2) d∝M 밀도와 분자량은 비례한다. + 혼합 기체라면 평균 분자량에 비례한다. 의 포인트이다. 이 문제에서도 마찬가지로 이 두 가지를 먼저 떠올렸어야 한다.
평균 분자량을 이용하려면 존재비를 알아야 하고, 그것을 알아내기 위해서는 제시된 Y원자수/X원자수, 그리고 Y원자수(상댓값)에 대한 자료를 이용해야 한다.
(다)에서 Y원자수/X원자수=8이므로 XZ를 1몰이라고 설정하면 Y₂Z는 4몰이 된다. 이를 이용하여 상댓값을 조정하면 Y원자 수는 (가), (나), (다)가 각각 8, 16, 8몰이 된다. 따라서 (가)에 들어 있는 X₂Y₂는 4몰이 되고, (나)에서 Y원자수/X원자수=16/4가 되므로 X₂Y₂는 2몰, Y₂Z는 6몰이 된다.
ㄱ선지를 보면 기체의 부피에 대해 묻고 있고, 이는 첫 번째 포인트로 잡은 ‘부피와 몰수가 비례한다’를 이용하면 위에서 구한 양으로 비교할 수 있다는 것으로 연결 지을 수 있다. 따라서 (다)5몰>(가)4몰로 옳은 선지가 된다.
ㄴ에서는 전체 기체의 질량을 구해야 하는 선지이고 여기서 두 번째 포인트가 등장한다. 앞서 언급한 것처럼 ‘d∝M 밀도와 분자량은 비례한다.’도 밀도 자료에서 중요 포인트지만, 항상 잊지 말아야 할 것은 기본 틀이다. ‘d=W/V’의 기본 틀은 잊어서는 안 되는 또 하나의 중요 포인트이다. 여기서도 이 틀을 이용하면 전체 기체의 밀도 x 부피, 즉 부피와 몰수가 비례하므로 우리가 구한 몰수를 이용하면 질량을 비교할 수 있게 된다. 따라서 13x4, 10x8, 10x5 중 80이 가장 크므로 (나)의 질량이 가장 크다는 ㄴ선지 또한 옳은 선지가 된다.
마지막 ㄷ선지를 보면 원자량의 비율을 물어보고 있기 때문에 여기서는 ‘d∝M 밀도와 분자량은 비례한다.’을 이용하면 된다. 그럼 (가)에서는 X₂Y₂의 분자량을 13으로 설정할 수 있고, (나)에서는 혼합 기체이므로 내분점을 이용하면 된다. 평균 분자량은 10이고 존재비는 X₂Y₂:Y₂Z=1:3이므로 3:1내분점을 활용하면 Y₂Z의 분자량은 9가 되는 것을 찾을 수 있다. (다)에서도 동일하게 이용하면 XZ:Y₂Z의 존재비는 1:4이고, 평균 분자량은 10이므로 XZ의 분자량은 14가 되는 것을 확인할 수 있다. 이 분자량들을 이용하여 원자량을 계산해 주면 X의 원자량:Z의 원자량이 3:4라는 것을 이끌어 낼 수 있으므로 ㄷ도 옳은 선지가 된다.
밀도 자료가 등장할 때, 앞으로는 같은 온도, 압력, 기체의 조건에서 어떤 것들을 습관적으로 떠올려야 하는지, 그리고 기본 틀은 잊지 않아야 한다는 것을 기억하고, 이를 다른 문제에도 꼭 적용해 봤으면 좋겠다.
[양서현의 센스있는 화학 특강] ‘밀도’ 자료 해석하기 : 화학식량과 몰
- 양서현 이투스 화학 강사가 센스있게 알려주는 화학 공부법
Copyrightⓒ Chosunedu All rights reserved.

![[양서현의 센스있는 화학 특강] ‘밀도’ 자료 해석하기 : 화학식량과 몰](https://edu.chosun.com/site/data/img_dir/2024/07/23/2024072380099_2.png)