-
오늘은 지난 칼럼에서 다루었던 ‘물의 자동 이온화’ 부분을 자세히 분석하려 한다. 지난 편에서는 문제 풀이 자체에 초점을 두면서 포인트를 언급했다면, 이번 시간에는 포인트를 이용해 어떤 유형의 문제들이 출제될 수 있는 지 살펴보자.
먼저, 언급했던 포인트 중 2가지를 리뷰해 보자.
①[H3O+][OH-]=10^-14
②pH+pOH=14
이 두 가지의 포인트는 개념적인 포인트이며, 자동으로 떠올릴 수 있어야 한다. 이 내용에서 문제로 연결될 수 있는 하나의 내용은 ①은 곱이 일정, ②는 합이 일정이라는 것이다.
-
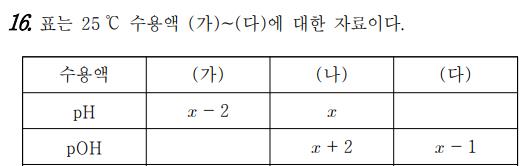
이런 문제가 등장한다면 우리는 개념 포인트를 떠올리며 자료 (나)에서 pH+pOH=14라는 것을 떠올려 x를 빠르게 구해내면 된다. 조금 더 난도를 높이면, 이런 개념적인 포인트들을 여러 개 섞어 출제된다. 지난 시간에 다룬 대소 관계를 제외한 ‘물의 자동 이온화’ 문제 유형을 크게 세 가지로 나눠보려고 한다.
개념 포인트만으로 등장할 수 있는 유형을 먼저 살펴보자.
첫 번째 유형은 ‘pH/pOH’ 유형이다. 자료에 분수값이 등장하면 괜히 긴장하는 학생들을 많이 볼 수 있다. 하지만 이 유형은 형태만 이럴 뿐, 매우 간단하다. ‘pH/pOH=y/x’라는 자료가 등장하면 pH+pOH=14라는 포인트를 떠올려 x+y값을 14로 맞춰주기만 하면 된다.
예를 들어 1) pH/pOH=5/2, 2) pH/pOH=3/25 라는 자료가 있다면, 첫 번째는 분모 분자의 합이 7이므로 14로 조정하기 위해 각각 2를 곱하면 pH=10, pOH=4가 되면서 합이 14가 되는 것까지 확인할 수 있다. 두 번째 자료는 분모와 분자의 합이 28이므로 14로 조정하기 위해 2로 나눠줘야 한다. 그러면 pH=1.5, pOH=12.5의 값이 나오게 되는 걸 알 수 있다.
두 번째 유형은 pH-pOH=x처럼 차이 값에 대한 문제이다. 이 유형을 본격적으로 이야기하기 전에 ‘기준’에 대한 생각을 먼저 해야 한다. ‘물의 자동 이온화’에서 늘 언급하는 숫자는 7이다. pH와 pOH의 값이 같을 때가 7이므로 강의에서 늘 기준을 7이라고 한다. 이 유형도 pH+pOH=14로 합이 일정하다는 것에서부터 시작된다. pH를 기준에서부터 2만큼 증가시키면 pOH는 2만큼 감소해야 한다. 합이 일정하므로 pH와 pOH 각각 기준(7)에서부터 오르락내리락 한 양이 같다는 것에 초점을 두면 된다.
문제에서는 유형 제목처럼 차이값을 주고 pH와 pOH를 각각 구하도록 출제가 된다. 물론 미지수로 두고도 구해낼 수 있지만 이 원리를 이해한다면 빠르게 답을 구해낼 수 있게 된다. 기준에서부터 증가량 감소량이 같으므로 차이값 자체를 반으로 나누면 오르락내리락한 ‘양’ 자체를 알게 된다. 추가 설명해보자면 pH=5, pOH=9라면(기준(7)로부터 각각 -2, +2) 이 둘의 차이값은 4가 된다. 역으로 차이값인 4를 반으로 나누고 7을 기준으로 오르락 내리락 시키면 된다. pH-pOH=x일 때, 7을 기준으로 x/2만큼 ‘오르락내리락!’을 꼭 기억했으면 하는 바람이다. pOH-pH=6이라면 3(6/2)을 7을 기준으로 오르락내리락한 4, 10이라는 숫자가 나오고 이를 조건에 맞게 pOH=10, pH=4로 설정하면 된다.
세 번째 유형은 [OH-]/[H3O+]=10^x 이다. 이 유형은 두 번째 유형과 매우 비슷하다. 이 유형에서는 [H3O+][OH-]=10^-14, 즉 곱이 일정하다는 것에서부터 시작된다. 이를 더 자세히 분석해 보면 저 14라는 값은 [H3O+], [OH-] 각각의 값의 지수끼리의 합에 의해서 나오게 되는 값이라는 것을 알 수 있다. 그뿐만 아니라 유형 제목에서 등장하는 저 분수값은 지수끼리의 차이가 x라는 것을 나타낸다. 따라서 두 번째 유형과 동일하게 풀이하되, 구한 값을 10^-★의 ★부분에만 잘 넣어주면 된다는 것만 기억하면 된다. [OH-]/[H3O+]=10^x라는 자료가 보인다면 두 번째 유형과 동일하게 7을 기준으로 x/2만큼 오르락내리락이다. 더불어 ‘ 10^-★ 틀에 넣자’까지 기억하면 된다.
[H3O+][OH-]=10^2라는 문제가 등장했다면 2를 반으로 나눈 1만큼을 7에서부터 오르락내리락해 숫자 6, 8을 얻어낼 수 있다. 조건에 맞게 틀에 넣고, 값을 설정해주면 [H3O+]=10^-6, [OH-]=10^-8을 쉽게 구할 수 있다. 지수로 표현되다 보니 마지막 처리하는 과정에서 실수하지 않도록 주의하는 것이 좋다.
지난 시간에 다뤘던 대소 관계 유형과 오늘 다룬 3가지 유형을 잘 정리해 두면 ‘물의 자동 이온화’ 문제에 대한 장벽이 깨질 것이다. 이 파트의 문제들을 연습할 때, 어떤 포인트들로 문제를 빠르게 풀어낼 수 있을까에 대한 고민을 하면서 연습해보면 좋겠다는 바람이다.
[양서현의 센스있는 화학특강] ‘물의 자동 이온화’ 문제 유형 분석 편
- 양서현 이투스 화학 강사가 센스있게 알려주는 화학 공부법
Copyrightⓒ Chosunedu All rights reserved.

![[양서현의 센스있는 화학특강] ‘물의 자동 이온화’ 문제 유형 분석 편](https://edu.chosun.com/site/data/img_dir/2024/06/11/2024061180057_2.png)