-
-
- 이투스에듀 제공.
-
화학1에서 학생들이 가장 두려워하는 파트 2가지가 있다. 1단원의 ‘화학 반응의 양적 관계’ 파트와, 4단원의 ‘중화 반응’이다. 이 두 파트는 문제에 주어진 여러 자료를 이용해 숨겨진 힌트를 발굴해 내고, 그 힌트 조각들을 맞춰 답을 완성해야 한다. 그러기 위해서는 자료마다 어떤 행동을 할 건지에 대한 습관이 머릿속에 정리되어 있어야 한다. 이번 시간에는 ‘중화 반응’을 6월 모의고사의 한 문제와 연결 지어 포인트를 설명해 보려 한다.
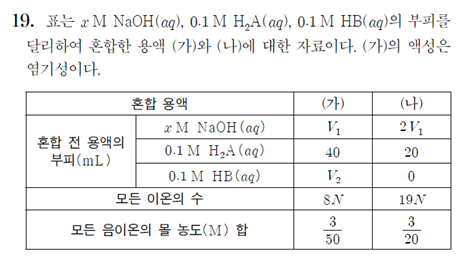
위 문제에서는 이온의 수, 음이온의 수를 빠르게 파악하는 것이 중요하다. 이것을 파악하기 위해서는 심화 포인트인 1가와 2가의 역할을 알아야 한다. 중화 반응에 등장하는 산과 염기에는 HB와 같은 1가와 H2A같은 2가가 있다. 전체 이온 수의 상황으로 상상해 보면 1가는 1덩어리가 들어갈 때마다 H+나 OH-를 1개를 없애고, 구경꾼 이온이 그 자리를 보상해 준다. 따라서 1가는 전체 이온 수에 영향을 주지 못한다.
2가는 1덩어리가 들어갈 때마다 H+나 OH-를 2개를 없애고, 구경꾼 이온이 1개만 보상해 준다. 따라서 2가는 영향력이 있고, 2가가 들어갈 때는 전체 이온 수는 2가 덩어리 수만큼 감소한다. 이것을 상상하는 것이 가장 중요하다. 이 상황을 나는 강의에서 1가의 역할 : 1kill 1보상, 2가의 역할 : 2kill 1보상이라고 부르고 이를 매우 강조한다. 기준을 잡는 방법, 이온 수를 판단하는 연습 등에 더 자세한 설명은 개념서를 참고하길 바란다.
-
-

- 양서현 이투스 화학 강사.
-
(가)의 액성은 염기성이라고 주어져 있고, (나) 상황을 파악해 보면 (가)보다 염기의 양은 더 많고, 산의 양은 줄었으므로, (나)의 액성도 염기성이다. 모든 이온의 수 자료를 이용할 때, 위에서 언급한 포인트가 여기서 빠른 판단에 이용된다. (가)는 1가 염기+2가 산+1가산이 혼합되어 있는 상황이다. NaOH에 H2A와 HB가 들어온다고 생각하면 HB는 1가로 1kill 1보상 해주기 때문에 전체 이온 수에 영향을 주지 않는다. 하지만 H2A는 2가로 2kill 1보상하기 때문에 초기 NaOH의 전체 이온 수에서 2가 덩어리 수만큼 감소하게 된다. (나)의 상황은 1가 염기+2가산 이므로 NaOH에 H2A가 들어온다고 생각하면 2kill 1보상이므로 여기서도 2가 덩어리 수만큼 감소할 것이다. H2A는 농도와 부피 모두 주어져 있으므로 이를 곱하면 40mL에는 4만큼, 20mL에는 2만큼 존재한다.
NaOH의 농도와 부피는 숨겨져 있으므로 V1mL에 있는 NaOH의 양을 k라고 하자. 위에서 설명한 전체 이온 수를 식으로 표현하면 초기 NaOH의 전체 이온 수-2가 덩어리 수이고, 따라서 (가)에서는 2k-4, (나)는 4k-2이다. 자료에서 모든 이온이 수가 (가)는 8N, (나)는 19N이므로, 이 둘의 비가 8:19라는 것을 이용하면 k=10이 나오게 된다.
이 포인트는 음이온 수에서도 동일하게 활용할 수 있는데, (가)의 상황을 위와 똑같이 NaOH에 1가와 2가 산이 들어왔다고 보면, 산이 들어오기 전 초기에는 음이온이 OH-만 있다. 1가인 HB는 위와 마찬가지로 OH-를 1kill하고 음이온인 B-가 그 자리를 보상해 준다. 따라서 음이온 수에도 1가는 영향을 미치지 못한다. 하지만 2가인 H2A는 OH-를 2kill하고 A^-2가 한자리만 보상해주기 때문에 음이온 수도 초기 OH-수에서 A^-2, 즉 2가 덩어리 수만큼 감소하게 되는 것이다. 따라서 음이온 수 판단도 빠르게 (가)에서는 k-4, (나)는 2k-2, 즉 각각 6, 18이라는 것을 구할 수 있게 된다. 이후의 계산은 음이온의 몰 농도 합 자료인 분수값을 이용하여 (가)와 (나)의 부피가 각각 100, 120이라는 것을 구할 수 있게 되고, 이것을 통해 마지막 식을 세워 계산만 하면 V1, V2을 구해낼 수 있게 되고, 이를 이용해 NaOH의 농도인 x까지 구해내면 된다. 오늘의 주제는 1가와 2가의 역할이기 때문에 마지막 계산은 해설 강의를 참고하길 바란다.
결국 이 문제에서는 모든 이온의 수와 음이온 수를 잘 파악할 수 있느냐가 포인트인 것이다. 전체 이온 수와 음이온 수뿐만 아니라, 양이온 수의 자료가 등장하는 문제로 변형되어도 1가와 2가의 역할만 이해했다면 빠르게 구해낼 수 있기 때문에 ‘중화 반응’을 공부할 때에는 늘 1가와 2가의 역할이 무엇이었는지에 대해 상상을 하면서 공부했으면 좋겠다는 바람이다. 1가는 1kill 1보상, 2가는 2kill 1보상! 이 마법의 키워드를 잊지 말자.
-
-
- 양서현 이투스 화학 강사가 센스있게 알려주는 화학 공부법
Copyright Chosunedu All rights reserved.


