-
화학1은 단원별로 자주 나오는 유형의 문제들이 있다. 이러한 문제들이 고난도로 출제될수록 주어진 시간 내에 풀어내기 위해 꼭 가져야 할 것은 ‘일관된 풀이법’이다. 문제에서 제시된 조건과 자료들을 해석할 때, 유형마다 필요한 포인트들을 머릿속에 정리해 둔다면 새로운 문제를 만나도 당황하지 않고 정해진 루틴대로 진행할 수 있다.
이번에 소개할 문제는 4단원의 주제 중 하나인 [물의 자동 이온화]이다. 거의 매번 출제되는 파트로, 자료가 조금만 복잡해져도 오답률 상위권을 차지하는 문제 유형이다. 이 문제 역시 생각해 내야 하는 포인트, 틀만 습관화해 두면 수월하게 풀어낼 수 있다. 이번에 치러진 5월 학력평가의 문제로 몇 가지 포인트를 함께 살펴보자.
[물의 자동 이온화] 파트에서 떠올려야 하는 대표 포인트 3가지를 써보자면 ①[H3O+][OH-]=10^-14 ②pH+pOH=14 ③M(몰농도)= 용질의 몰수(n)/용액의 부피(V)이다.
이 3가지는 문제를 보자마자 머릿속에서 자동으로 스쳐야 한다. 아직 스치지 않는다면 기출문제에 대한 분석을 조금 더 해야 한다. 이 유형의 문제에서 자주 등장하는 선지는 위 문제와 비슷하게 몰농도, pH/pOH, 그리고 부피가 주어진다면 H3O+, OH-의 양을 물어보는 선지이다.
-
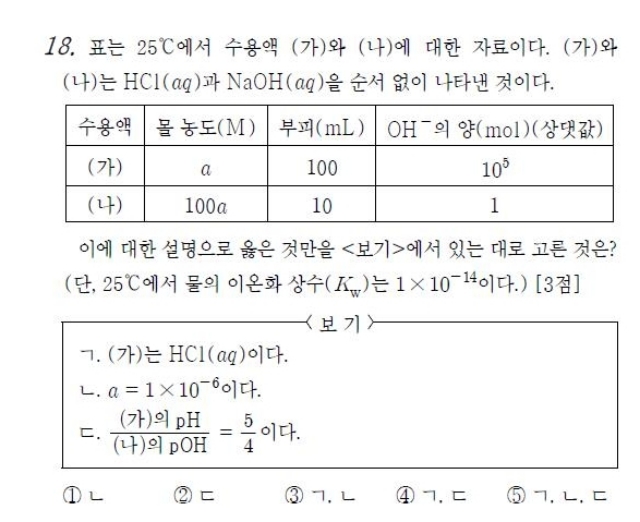
① 문제를 풀기 위한 첫 번째 단계는 비교적 쉽다. OH-의 양의 비율, 그리고 부피가 주어져 있기 때문에 위 포인트 중 ③을 사용할 수 있다. (가):(나)의 OH-의 양은 10^5:1, 부피는 10:1이므로 [OH-]는 10^4:1이라는 것으로 이끌어낼 수 있다. 따라서 (가)가 NaOH(aq), (나)는 HCl(aq)로 결정된다.
두 번째 단계에서 조금 더 난이도 있는 포인트를 알고 있으면 도움이 많이 된다. 바로 ‘대소 비교’라는 포인트이다. [물의 자동 이온화] 유형에서 ‘대소 비교’ 포인트를 이용하면 문제를 더 빨리 해결할 수 있게 된다.
예를 들어 설명을 조금 해보자면 [H3O+]가Ⅰ이 10^-2, Ⅱ는 10^-4로 Ⅰ이 Ⅱ의 100배라면, Ⅰ의 pH는 2, Ⅱ의 pH는 4로, pH는 Ⅰ이 Ⅱ보다 2만큼 작다. 내 경우는 강의에서 pH, [H3O+] / pOH, [OH-]를 각각 짝꿍이라고 부르고 pH=-log[H3O+], pOH=-log[OH-]이므로 앞의 예에서처럼 몰농도가 10^2배 크면 pH/pOH관계는 -2가 되는 것을 짝꿍끼리는 대소의 부호가 반대, 숫자는 그대로 꺼내기! 라고 포인트로 암기하는 것을 강조한다.
② 앞서 설명한 포인트를 이용해 보면 (나)의 몰농도가 (가)의 몰농도의 100배이므로 (나)의 pH가 (가)의 pOH보다 2만큼 작다. 따라서 (가)의 pOH를 x라고 하면, (나)의 pH는 x-2가 된다. 이 포인트를 ①에서 구한 것에도 적용할 수 있다. (가)의 [OH-]는 (나)의 10^4이므로 (가)의 pOH는 (나)의 pOH보다 4만큼 작아야 하므로 (나)의 pOH는 x+4라고 표현할 수 있다.
③ 마지막 처리에서 포인트 ② pH+pOH=14를 사용해 주면 (나)에서 (x-2)+(x+4)=14, x=6이다. 따라서 α=1X10^-6 이 되고, (가)의 pH는 8, (나)의 pOH는 10이 되므로 (가)의 pH/(나)의 pOH = 4/5가 된다.
앞서 말한 포인트 3가지와 ‘대소 비교’ 포인트를 기억하고 있으면 앞으로 [물의 자동 이온화] 문제를 푸는 데 큰 어려움이 없을 것으로 생각한다. 이 파트는 연습하면 잡을 수 있는 문제이기 때문에 화학을 선택한 학생들이 이 포인트들을 적극 활용해 문제를 푸는 연습을 해보면 좋겠다는 바람이다.
[양서현의 센스있는 화학특강] 자료 해석 포인트를 떠올리는 습관을 갖자 : ‘물의 자동 이온화’ 편
- 양서현 이투스 화학 강사가 센스있게 알려주는 화학 공부법
Copyrightⓒ Chosunedu All rights reserved.

![[양서현의 센스있는 화학특강] 자료 해석 포인트를 떠올리는 습관을 갖자 : ‘물의 자동 이온화’ 편](https://edu.chosun.com/site/data/img_dir/2024/05/21/2024052180045_2.png)